











《氯气的实验室制法 氯离子的检验》氯及其化合物PPT
第一部分内容:必备知识·素养奠基
一、氯气的制法
氯气的实验室制法
(1)反应原理:实验室用MnO2和浓盐酸加热
反应制取Cl2,反应的化学方程式为________________________________,
离子方程式为_______________________________。
(2)实验装置
烧杯中NaOH溶液的作用是___________________________。
【想一想】
(1)浓盐酸与足量的MnO2反应时,HCl能完全反应吗?为什么?
提示:不能,因为随着反应的进行,盐酸的浓度变小,MnO2与稀盐酸不反应。
(2)如何检验氯气已经收集满?
提示:将湿润的淀粉KI试纸放到瓶口,Cl2能使湿润的淀粉KI试纸变蓝。
二、Cl-的检验
1.实验探究
2.氯离子的检验方法
(1)操作方法:向未知溶液中先加_________,再加_______。
(2)现象:产生_________,加稀硝酸时,沉淀_______。
(3)原理:_________________。
(4)加入稀硝酸的目的:排除_____等离子的干扰。
【情境·思考】
家中有一碗水,姐姐说是蒸馏水,弟弟说是盐水,想一想如何证明这碗水是否含有NaCl?
提示:利用焰色试验为黄色证明Na+的存在;加入硝酸酸化的硝酸银溶液,生成白色沉淀,证明Cl-的存在。
... ... ...
氯气的实验室制法氯离子的检验PPT,第二部分内容:关键能力·素养形成
知识点一 氯气的实验室制法
【重点释疑】
1.制备流程
2.验满
【思考·讨论】
(1)实验室制备氯气的装置中,盛放饱和食盐水和浓硫酸的洗气瓶能否颠倒位置?为什么?
提示:不能。若颠倒位置浓硫酸将水蒸气吸收后,气体通过饱和食盐水时又会混入水蒸气。
(2)将1 mol MnO2与含4 mol HCl的浓盐酸反应,能否制得1 mol Cl2?为什么?
提示:MnO2与浓盐酸反应,不与稀盐酸反应,随着反应进行浓盐酸变稀后,剩余的HCl不再与MnO2反应,所以1 mol MnO2与含4 mol HCl的浓盐酸反应制得的Cl2少于1 mol。
(3)某同学认为可以用澄清石灰水代替氢氧化钠溶液进行尾气处理,同时还可以制得漂白粉,你认为该同学的想法是否合理?
提示:不合理。澄清石灰水的浓度很小,不能确保氯气被完全吸收,制备漂白粉应该利用氯气与石灰乳反应。
... ... ...
知识点二 以氯气的制备为例探究实验室气体制备思路
【重点释疑】
1.设计气体制备装置的基本思路
2.气体制备装置的连接顺序
3.装置要点分析
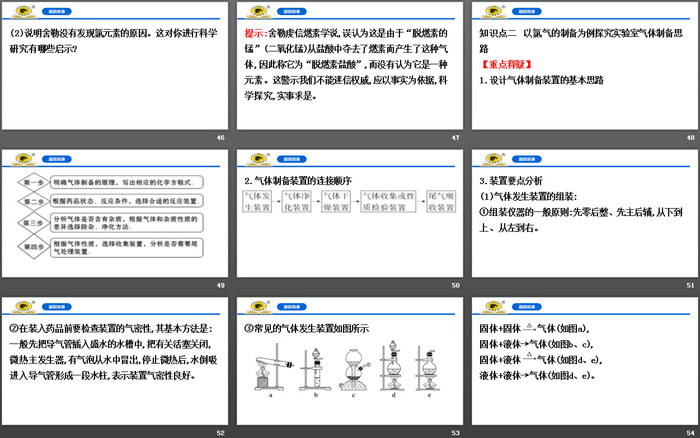
(1)气体发生装置的组装:
①组装仪器的一般原则:先零后整、先主后辅,从下到上、从左到右。
②在装入药品前要检查装置的气密性,其基本方法是:一般先把导气管插入盛水的水槽中,把有关活塞关闭,微热主发生器,有气泡从水中冒出,停止微热后,水倒吸进入导气管形成一段水柱,表示装置气密性良好。
③常见的气体发生装置如图所示
固体+固体 气体(如图a),
固体+液体→气体(如图b、c),
固体+液体 气体(如图d、e),
液体+液体→气体(如图d、e)。
(2)除杂净化和干燥仪器的组装:
①净化原则:不减少被净化气体的量;不引入新杂质;操作简便,易于分离。
②净化装置:
装置Ⅰ(洗气瓶):盛液体除杂试剂,气流方向是长管进,短管出。
装置Ⅱ(干燥管):盛固体除杂试剂,气流方向是粗口进,细口出。
... ... ...
氯气的实验室制法氯离子的检验PPT,第三部分内容:知识关联·素养应用
【核心整合】
1.氯元素的二维价态图
2.实例分析
(1)将新鲜的花瓣放入干燥的氯气中可观察到的现象是_________,原因是____________________________________________________。
(2)氯水久置或光照条件下均会变成稀盐酸,同时释放出氧气,说明次氯酸_______,反应的化学方程式为__________________。
【素养迁移】
1.下列关于氯气的说法正确的是 ( )
A.氯气在常温下能与铁反应,故不能用铁罐存放液氯
B.点燃氢气和氯气的混合气体可以制取氯化氢
C.氯气氧化性很强,一般都能将还原剂氧化为它的最高价态
D.氯原子最外层有7个电子,所以氯元素只有-1价和+7价
【解析】选C。氯气是一种化学性质非常活泼的非金属单质,几乎能与所有金属化合,但与金属反应时通常都需加热,常温或低温条件下,干燥氯气不能与铁反应,故常温下能用铁罐存放液氯,A不正确;在空气中燃烧着的氢气可以在氯气中继续安静地燃烧,生成氯化氢,工业上就是利用这一原理来制备氯化氢的,但如果点燃的是氢气和氯气的混合气体,则可能会发生爆炸,B不正确;
2.(2019·邵阳高一检测)用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是( )
A.漂白粉被氧化了
B.有色布条被空气中的氧气氧化了
C.漂白粉跟空气中的CO2反应充分,生成了较多量的HClO
D.漂白粉溶液蒸发掉部分水,其浓度增大
【解析】选C。对于漂白粉来说,其具有漂白作用主要是由次氯酸引起的,当漂白粉放置在空气中时,漂白粉会和空气中的CO2和H2O发生反应:Ca(ClO)2+CO2+H2O====CaCO3↓+2HClO,所以会使HClO的浓度增大,漂白效果变得更好。
... ... ...
关键词:人教版高中化学必修一PPT课件免费下载,氯气的实验室制法氯离子的检验PPT下载,氯及其化合物PPT下载,.PPT格式;












