


《微项目 科学使用含氯消毒剂》元素与物质世界PPT课件
第一部分内容:素养目标
1.从物质类别、元素化合价的角度,预测含氯消毒剂的性质。
2.了解生活中常见的含氯消毒剂,利用氧化还原反应分析并解释消毒剂在使用过程中产生的现象和出现的问题,体现化学的实用性和科学工作者的社会责任感。
3.强化合理使用化学品的安全意识,能够正确地使用含氯消毒剂。
... ... ...
微项目科学使用含氯消毒剂PPT,第二部分内容:知识铺垫
列举生活中常见的消毒剂。
(1)漂白粉;(2)84消毒液;(3)双氧水;(4)二氧化氯。
... ... ...
微项目科学使用含氯消毒剂PPT,第三部分内容:新知预习
1.84消毒液
(1)有效成分:NaClO。有效氯含量5.1%~6.9%。
(2)次氯酸钠,从氧化还原反应角度看,它属于氧化剂,从物质类别考虑它属于盐。
与稀酸反应生成次氯酸,如与水和空气中的二氧化碳反应,用化学方程式表示为NaClO+CO2+H2O=== NaHCO3+HClO。
(3)84消毒液有腐蚀性。若不慎将84消毒液沾到皮肤上,应立即用大量清水冲洗。
2.其他含氯消毒剂
(1)液氯:成分为Cl2。
(2)二氧化氯:分子式为ClO2。
(3)漂白粉:有效成分次氯酸钙(填名称)。
(4)有机含氯消毒剂:二氯异氰尿酸钠。
【微思考】分析含氯消毒剂NaClO2和无氯消毒剂K2FeO4,预测它们具有什么性质?
提示:根据次氯酸钠的性质,可推知消毒剂NaClO2和K2FeO4应该具有强氧化性。
... ... ...
微项目科学使用含氯消毒剂PPT,第四部分内容:探究
读84消毒液,探究其性质
问题探究
1.84消毒液的有效成分是次氯酸钠,它可能具有什么性质?
提示:在NaClO中Cl元素的化合价为+1价,具有强氧化性;NaClO属于盐,也可以与稀酸反应生成次氯酸。
2.为什么NaClO不能与洁厕灵(含有盐酸)等酸性产品同时使用?
提示:一方面是因为NaClO具有强氧化性,与盐酸发生氧化还原反应生成有毒的氯气:NaClO+2HCl === NaCl+Cl2↑+H2O;另一方面是因为NaClO与酸发生反应生成不稳定的HClO,HClO见光易分解。
知识归纳
探究次氯酸钠的性质:实验方案设计及实施
方法提炼1.预测和研究物质的思路
(1)研究物质的性质常用的基本方法有观察、实验、分类和比较。在观察过程中,不仅要用感官去搜集信息,还要积极地进行思考,及时存储和处理所搜集的信息。观察要有明确而具体的目的,要对观察到的现象进行分析和综合。
(2)如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过实验检验两者能否发生氧化还原反应,以验证预测。相应地,如果预测某物质具有还原性,就需要寻找具有氧化性的另一物质,通过实验验证预测。
(3)如果预测某物质是盐,就需要根据相关盐的性质预测和判断,通过实验验证预测。
2.分析和解决与化学相关的实际问题的思路方法
(1)分析实际问题中涉及哪些物质,有多种可能时,可逐一研究,也可将物质分类,选定代表物进行研究。
(2)预测选定的物质具有什么性质、可能发生哪些化学反应。
(3)推测事件中的现象或问题是由什么物质和变化引发的,提出假设。
(4)设计实验验证假设,注意使实验条件与真实情景保持一致,必要时设计控制变量的对比实验。
(5)思考对同一现象的解释是否存在其他假设,如存在时,进行必要验证。
... ... ...
微项目科学使用含氯消毒剂PPT,第五部分内容:随堂检测
1.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。
下列说法中正确的是( )
A.KClO3在反应中是还原剂
B.1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C.在反应中H2C2O4既不是氧化剂也不是还原剂
D.1 mol KClO3参加反应有1 mol电子转移
答案:D
解析:根据题给化学方程式分析,KClO3中氯元素化合价降低,作氧化剂;1 mol KClO3完全反应生成1 mol ClO2和1 mol CO2,在标准状况下的体积为44.8 L;H2C2O4中的碳元素化合价升高,做还原剂;1 mol KClO3参加反应时得到1 mol电子,即转移1 mol 电子。
2.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。填写下列空白。
(1)NaClO2是ClO2通入NaOH和H2O2混合液中制得的,氧化剂与还原剂的物质的量之比为___________,该反应的化学方程式为___________。
(2)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为___________。(计算结果保留两位小数)
答案:(1)2∶1 2ClO2+H2O2+2NaOH === 2NaClO2+O2↑+2H2O (2)1.57
解析:(1)根据题给信息,由ClO2生成NaClO2,Cl元素的化合价由+4价变为+3价,化合价降低,ClO2为氧化剂,则H2O2为还原剂,氧元素化合价升高生成氧气,再由电子守恒得,反应中氧化剂与还原剂的物质的量之比为2∶1,H2O2对应的氧化产物是O2。反应的化学方程式为2ClO2+H2O2+2NaOH === 2NaClO2+ O2↑+2H2O。
(2)由信息知,要求出每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,先求得1 g NaClO2转变为Cl-转移电子的物质的量为1÷90.5×4 mol,再设有x g Cl2变为Cl-的氧化能力与1 g NaClO2的氧化能力相当,列方程得1÷90.5×4=x÷71×2,解得x≈1.57,即为有效氯含量。
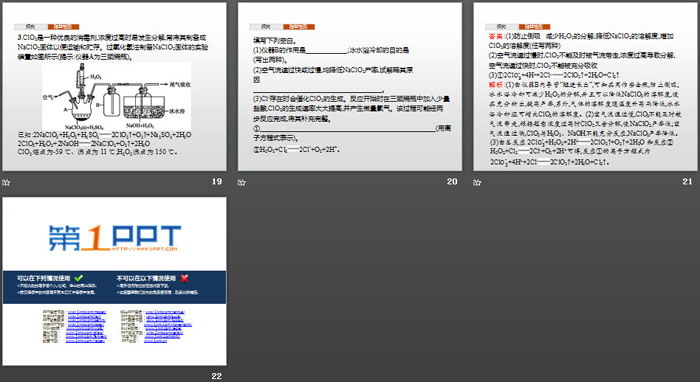
3.ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图所示(提示:仪器A为三颈烧瓶)。
已知:2NaClO3+H2O2+H2SO4 2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH 2NaClO2+O2↑+2H2O
ClO2熔点为-59 ℃、沸点为11 ℃;H2O2沸点为150 ℃。
填写下列空白。
(1)仪器B的作用是________________;冰水浴冷却的目的是______________________________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________________________。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整。
①______________________________(用离子方程式表示)。
②H2O2+Cl2 2Cl-+O2+2H+。
... ... ...
关键词:鲁科版高中化学必修一PPT课件免费下载,微项目科学使用含氯消毒剂PPT下载,元素与物质世界PPT下载,.PPT格式;












